TITRASI KADAR ASAM ASETIL SALISILAT DALAM OBAT ASPIRIN MELALUI METODE TITRASI ASAM BASA
David Lie ( 10 )
Dean Ascha Wijaya ( 11 )
Delwyn Kosmon ( 12 )
SMA XAVERIUS 1 JAMBI
XI IPA 2
KATA PENGANTAR
Puj Syukur kami panjatkan kehadiran Tuhan Yang Maha Esa atas segala limpahan rahmat dan karuniaNya, kami masih diberikan kesempatan untuk dapat menyelesaikan laporan praktikum yang diberikan oleh Bu Elizabeth Tjahjadarmawan.
Kami mengucapkan terima kasih kepada Bu Elizabeth Tjahjadarmawan selaku guru pembimbing yang telah memberi bimbingan sehingga kami mampu menyelesaikan laporan praktikum ini. Kami harap semoga laporan praktikum ini bermanfaat bagi para pembacanya.
Jambi, 20 April 2016
-Delwyn, David, Dean
TUJUAN
Tujuan dari penelitian ini adalah menentukan kadar asam asetil salisilat dalam obat aspilet ( aspirin ) menggunakan metode titrasi asam basa.
-Delwyn, David, Dean
MANFAAT
Melalui praktikum ini diperolah kadar asam asetil salisilat dalam tablet aspirin dengan metode titrasi asam basa. Dari hasil massa dan kadar asam asetil salisilat yang diperoleh melalui praktikum akan dibandingkan kadar obat pada merek dagang yang telah ditentukan.
-Delwyn, David, Dean
TEORI DASAR
Aspirin adalah obat analgesik pereda nyeri. Aspirin mengandung asam asetil salisilat yang merupakan asam monoprotilik. Aspirin dapat disintesis dari sama salisilat yang diasetilasikan dengan asetil klorida atau anhibrida asam asetat menurut reaksi berikut.
Salisin , sebagai salah satu beta-glikosida dari asam
salisilat, yang dapat ditemukan pada daun dan kulit kayu dari pohon willow (
genus Salix ) telah digunakan untuk penanganan herbalik selama berabad-abad
kurang lebih 2400 tahun. Dalam penggunaan pada organime hidup, salisin diubah
menajdi asal salisilat untuk meredakan pembengkakan dan menurunkan demam.
Asam salisilat sendiri kurang cocok dipergunakan sebagai obat-obatan karena dosis tinggi asam salisilat memiliki rasa yang tidak enak dan dapat menyebabkan iritasi lambung. Masalah ini terlampaui dengan perkenalan atas asam asetil salisilat atau "Aspirin" yang diregistrasikan dan dibuat oleh perusahaan obat Jerman , Bayer pada 1899. Nama "Aspirin" berasal dari "acetylated spiraeic acid" yang merupakan nama lama dari asam salisilat. Aspirin sendiri adalah ester dari asam salisilat yang dapat melewati lambung tanpa berubah sebelum mengalami hidrolisis oleh media basa pada usus yang mengaktifkan senyawa ini.
Aspirin bekerja dengan menghambat produksi prostaglandin yang diproduksi oleh seluruh bagian tubuh dimana zat ini berpengaruh dalam memberikan sensasi rasa sakit dan pembengkakkan. Aspirin dikonsumsi dengan dosis rendah untuk mencegah penyakit stroke pada orang-orang dengan tekanan darah tinggi. Aspirin dapat menyebabkan nyeri perut dan alergi pada anak-anak yang dapat berpotensi menyebabkan Sindrom Reye.
Asam salisilat sendiri kurang cocok dipergunakan sebagai obat-obatan karena dosis tinggi asam salisilat memiliki rasa yang tidak enak dan dapat menyebabkan iritasi lambung. Masalah ini terlampaui dengan perkenalan atas asam asetil salisilat atau "Aspirin" yang diregistrasikan dan dibuat oleh perusahaan obat Jerman , Bayer pada 1899. Nama "Aspirin" berasal dari "acetylated spiraeic acid" yang merupakan nama lama dari asam salisilat. Aspirin sendiri adalah ester dari asam salisilat yang dapat melewati lambung tanpa berubah sebelum mengalami hidrolisis oleh media basa pada usus yang mengaktifkan senyawa ini.
Aspirin bekerja dengan menghambat produksi prostaglandin yang diproduksi oleh seluruh bagian tubuh dimana zat ini berpengaruh dalam memberikan sensasi rasa sakit dan pembengkakkan. Aspirin dikonsumsi dengan dosis rendah untuk mencegah penyakit stroke pada orang-orang dengan tekanan darah tinggi. Aspirin dapat menyebabkan nyeri perut dan alergi pada anak-anak yang dapat berpotensi menyebabkan Sindrom Reye.
Kosentrasi aspirin dapat ditentukan dengan cara meneteskan larutan NaOH 0,1 M persamaan reaksi kimia sebagai berikut :
Titik Ekuivalen ditandai oleh terjadinya perubahan warna larutan menjadi pink muda, dengan indikator pp, yang konstan selama 1 menit. Kadar titran NaOH yang berlebih mengakibatkan terjadinya reaksi sebagai berikut :
Titik ekuivalen ditandai oleh terjadinya perubahan
warna larutan menjadi pink muda ( dengan indikator pp : phenolophetalien ) yang
konstan selama satu menit. Saat alkohol atau fenol bereaksi dengan asam
karboksilat , akan dihasilkan ester dan air. Esterifikasi berlangsung lama dan
tepat setelah produk terbentuk, reaksi hidrolisis dimulai. Kesetimbangan
tercapai apabila semua reaktan dan produk ditemukan (ada).
Pada suhu 20 derajat Celsius, kecepatan reaksi baik maju atau mundur berlangsung sangat lambat dan kesetimbangan hanya dapat tercapai setelah berhari-hari. Pemanasan meningkatkan kecepatan reaksi maju maupun mundur sehingga kesetimbangan lebih cepat tercapai, tanpa menggeser kesetimbangan secara signifikan. Nilai setimbang konstan (K) pada suhu ruangan sekitar 10 sehingga persentase produk yang dihasilkan tidak akan begitu besar.
-Delwyn, David, Dean
ALAT DAN BAHAN
1. Tablet aspirin
2. Air mineral 600ml
3. Tissue
4. Label
5. Lap
6, Gelas plastik 5 buah
7. Sendok 5 buah
8. Lumpang porselin
9. Timbangan digital
10. Erlemeyer 250ml
11. Gelas ukur
12, Etanol 95%
13. Hot plate
14. Pipet tetes
15. Indikator pp
16. Larutan NaOH
17. Burret
-Delwyn
METODE
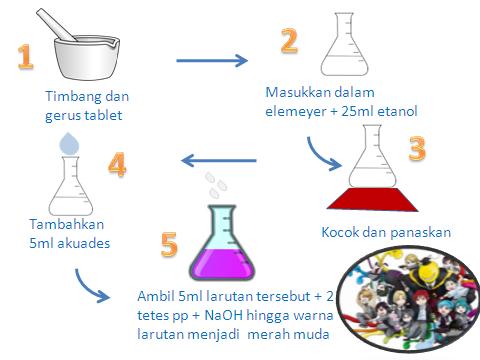
1. Timbang tablet aspirin menggunakan timbangan digital.
2. Geruslah tablet yang akan dianalisa dengan lumpang porselin sampai halus.
3. Masukkan tablet yang telah dihaluskan kedalam erlemeyer 250ml.
4. Tambahkan 25ml etanol 95% ke dalam erlemeyer.
6. Tambahkan 5ml akuades kemudian ambil 5ml campuran tersebut, kemudian pindahkan ke erlemeyer lainnya.
8. Teteslah larutan NaOH 0,1 M sampai warna larutan berubah menjadi pink muda dan catatlah.
-Delwyn, David, Dean
BAGAN METODE
-David
HASIL PRAKTIKUM
PERHITUNGAN
HASIL DAN PEMBAHASAN
SARAN
Baker, R.W et al. 2008. Chemistry 1 Laboratory Handbook.
Sydney : School of Chemistry
KONTRIBUTOR
-David
PERHITUNGAN
Menghitung kadar asam asetil salisilat dalam obat analgesik Cardia Aspirin
- Massa 1 butir tablet : 0,14 gram, pada label obat ; 100mg asetil salisiat
- Vol NaOH rata - rata ; 1,1ml
- MNaOH ; 0,1025 M
-Dean
HASIL DAN PEMBAHASAN
Aspirin atau asam asetil salisilat adalah obat turunan dari salisilat yang sering digunakan sebagai senyawa analgesik (penahan rasa sakit atau nyeri minor), antipiretik (terhadap demam), dan anti-inflamasi (peradangan).Pada obat yang di pasarkan, asam asetil salisilat yang terkandung tidaklah 100%. Dari hasil praktikum didapatkan bahwa dalam tablet 0,14g pada nyatanya berisi 0,12g asam asetil salisilat atau 87,05%. Selisih tersebut diduga karena adanya bahan tambahan dalam obat.
-David
KESIMPULAN
Dari titrasi asam basa
menggunakan NaOH 1,025M, didapat kadar asam asetil salisilat sejumlah
0,1218672mg per tablet. Berdasarkan berat tablet 0,1g per tablet, maka
diperoleh persentase asam salisilat sejumlah 71,4285% ( fakta ). Sedangkan pada
kemasam tertera kadar asam asetil salisilat sejumlah 100mg sehingga
menghasilkan persentase 87,05 ( teori ). Dari kedua hasil yang diperoleh didapat
persen hasil 1,2187%
-Delwyn
1. Berhati-hatilah ketika memindahkan gerusan tablet ke elemeyer agar tidak ada yg tumpah sehingga berat a tablet sebelum di gerus sama dengan berat tablet setelah digerus dan dilarutkan.
2.Selain dengan cara tetes, praktikum ini juga dapat dilakukan dengan cara titrasi.
3. Bila menggunakan cara titrasi, kurangi sedikit titran hingga tepat ke angka yang mudah di lihat agar dapat lebih mudah melihat volume titran yang digunakan.
4. Ketika menggunakan cara tetes, hitung setiap tetesan dengan teliti agar tepat ketika dikonversi ke volume (1 tetes = 0,05ml)
-David
KATA PENUTUP
Demikian yang dapat kami sampaikan dalam laporan ini. Terima kasih pada Bu Elizabeth Tjahjadarmawan yang telah memberikan pengarahan dalam pembuatan laporan maupun dalam praktek. kami mohon maaf bila ada kesalahan dalam laporan ini dan semoga laporan ini dapat bermanfaat bagi para pembaca.
Jambi, 23 April 2016
-Delwyn
DAFTAR PUSTAKA
Tjahjadarmawan, Elizabeth. 2016. Bernas Kimia Jilid 2.
Jogjakarta : Citra Media
Admin
Delwyn Kosmon
Analis Laporan
David Lie, Dean Ascha Wijaya, Delwyn Kosmon
Cameramen
Dean Ascha Wijaya